王紅勝課題組在m6A調控腫瘤細胞上皮間質化方向取得新進展
近日,我院王紅勝課題組在Nature Communications期刊上發表題為“RNA m6A methylation regulates the epithelial mesenchymal transition of cancer cells and translation of Snail” 的研究論文,發現腫瘤細胞上皮間質化(EMT)過程中mRNA的m6A顯著上調,其可通過促進EMT關鍵轉錄因子Snail的翻譯從而促進腫瘤EMT及侵襲轉移。 文章鍊接:https://www.nature.com/articles/s41467-019-09865-9
EMT是上皮細胞獲得間充質細胞特質的一種重要現象,即細胞獲得具有纖維母細胞樣的形态,增強的運動性,通過丢失黏附性和緊密連接,跨越基膜與鄰近細胞進行交流。EMT的概念最初由胚胎學領域的發育生物學家提出,近年來已擴展到腫瘤的進展、侵襲和轉移,被認為是腫瘤轉移起始和關鍵步驟。其表型為上調間充質标志物,下調上皮标志物如E-Cadherin,使細胞從基底部脫落,細胞膜變得更具紡錘形表型和運動性,并獲得細胞凋亡抵抗,其中轉錄因子Snail在其中發揮重要促進作用。 近年來圍繞EMT的表觀遺傳調控因素做了諸多研究,發現DNA甲基化及組蛋白修飾等均可參與腫瘤細胞EMT的發生發展,但mRNA修飾對腫瘤細胞EMT的影響尚未揭示。
本研究發現,在腫瘤細胞EMT過程中,mRNAs的m6A修飾增加。甲基轉移酶METTL3的缺失使得m6A水平下調,并抑制癌細胞在體外和體内的遷移、侵襲和EMT過程。m6A-seq和功能實驗表明,EMT的關鍵轉錄因子Snail的表達受m6A調控,且過表達Snail能逆轉METTL3缺失導緻的細胞EMT抑制。進一步研究表明,Snail mRNA的CDS區而非3’UTR區的m6A修飾,可促進其mRNA的翻譯延伸,其可能機制是通過YTHDF1與eEF-2的共結合促進多聚核糖體對其的翻譯作用。體内實驗表明METTL3敲除細胞株轉移能力較野生型顯著下調,過表達Snail則可在一定程度上逆轉此現象。臨床分析表明肝癌組織中Mettl3和YTHDF1表達高于癌旁組織,其上調是肝癌患者總體生存率(OS)不良預後因素。
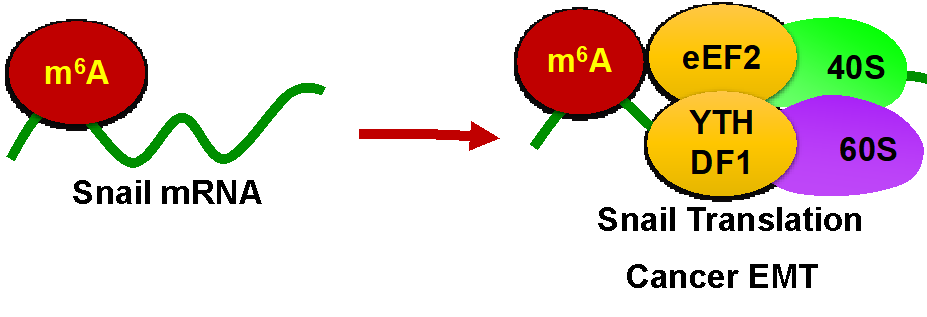
圖1 m6A調控Snail翻譯及腫瘤細胞EMT示意圖
上述研究工作獲得國家自然科學基金及廣東傑出青年科學基金等多項基金的資助及芝加哥大學何川教授、中山大學生命科學院駱觀正教授、浙江大學劉建钊教授等課題組的幫助。

